Unidad 5
Estructura atómica
5.1 Evolución histórica de los modelos atómicos
5.1.1 Demócrito y Leucipo (Griego - S. V a. C.)
Para Demócrito los átomos tenían formas, tamaños y pesos diferentes: presentaban superficies tanto lisas e irregulares. Y se encontraban en todas partes.
5.1.2 Pierre Gassendi (Francés - 1630) El profesor Gassendi imagina a los átomos provistos de ganchos que permiten mantenerlos unidos.
5.1.3 Jhon Dalton (Inglés - 1800) Dalton resume su modelo en las siguientes ideas.
5.1.4 Joseph Jhon Thomson (Inglés - 1897)
Descubre el electrón su modelo atómico presenta un modelo eléctrico del átomo con cargas eléctricas positivas y negativas.
5.1.5 Ernest Rutherford (Inglés - Premio Nobel 1908).
Basa su modelo en la radioactividad descubierta por Becquerel estudiando los rayos alfa (corrientes de partículas de carga eléctrica positiva), rayos beta (corrientes de electrones), rayos gamma.
La experimentación de Rutherford con radiaciones consistió en bombardear con partículas alfa una lamina de oro cubierta con una pantalla de sulfuro de zinc. El experimento demostró que algunas partículas no perdían la trayectoria, otras eran desviadas y algunas se devolvían en la misma dirección que habían llegado.
Experimento de Rutherford
De esta manera Rutherford obtuvo resultados que le ayudaron a formular una nueva teoría acerca de la estructura atómica. "El átomo esta formado por dos partes núcleo (parte central de tamaño pequeño con carga positiva). Corteza atómica (espacio de carga negativa).
5.1.6 Niels Bohr
Bohr sugiere un modelo de átomo en el cual los electrones tienen un orden definido entorno al núcleo y giran en determinadas órbitas, la base de su estudio fueron los espectros de emisión y la mecánica cuántica o teoría de los cuantos.
5.1.6.1 Espectros de emisión
Los átomos pueden absorber o emitir luz. La luz que emite un elemento se conoce como espectro y cada elemento tiene un diferente. Ejemplo: El neón es un elemento que al excitarse energéticamente, emite radiación de una longitud de onda correspondiente a la luz roja; los letreros luminosos de neón presentan este color.
5.1.6.2 Teoría de los cuantos
Fue promulgada por Planck en 1.900. "En una reacción química no puede intervenir una cantidad de materia inferior a un átomo. Igualmente, hay una mínima cantidad de energía que se puede emitir que es el cuanto o fotón".
5.1.6.3 Conclusiones de Bohr
1. Los átomos absorben o emiten energía, lo hacen únicamente en cuantos.
2. Bohr sugirió que los electrones debían hallarse en órbitas de cierto tamaño, moviéndose a cierta velocidad y con determinada energía (niveles de energía).
5.2 Retomemos las teorías y hagamos una visión moderna del átomo.
5.2.1 Partículas subatómicas
Seria muy dispendioso abarcar la totalidad de las partículas subatómicas por lo tanto estudiaremos las más conocidas.
5.2.1.1 Protones
Son partículas que se hallan en el núcleo del átomo. Tienen una masa mayor que la de los electrones y una carga eléctrica positiva. Se representan por: p+. De los protones depende la carga nuclear.
5.2.1.2 Neutrones
Partícula que se halla en el núcleo del átomo. Posee masa aproximadamente igual a la de los protones, pero no tienen carga eléctrica. Por lo general, el número de neutrones que posee un átomo es superior al número de protones. Se representan por: n° y se conocen como nucleones. Estudios recientes sobre los protones y neutrones han determinado que dichas partículas se encuentran formadas por unas más pequeñas llamadas quarks.
5.2.1.3 Electrones
Estas partículas se encuentran en la periferia o corteza del átomo, girando a grandes velocidades en siete niveles y cuatro subniveles de energía. Poseen una
Los electrones del átomo poseen determinada cantidad de energía y según ella se logran localizar. Si cuentan con poca energía, se localizan cerca al núcleo, si el caso es contrario, se ubicarán lejos de él. La posición que ocupa el electrón en la corteza del átomo no se puede determinar con exactitud, según los estudios realizados por Heissemberg creador del principio de incertidumbre de su mismo nombre, "No podemos determinar con exactitud la posición y velocidad de un electrón en un átomo".
Los electrones se desplazan en forma veloz y constante dentro de cada orbital y lo hacen con un movimiento de traslación alrededor del núcleo. Además, ellos poseen otro movimiento sobre su eje y es conocido como spin y se representan por flechas. Los electrones del mismo orbital siempre tienen spines contrarios, o sea, que cuando uno gira sobre su eje hacia la izquierda, el otro lo hace hacia la derecha.
5.2.2 Número atómico:
El número de protones de un átomo se conoce como número atómico y se representa Z. Los elementos se representan siempre por el número atómico y el de cada uno es particular porque no existen dos elementos con el mismo número atómico, además, éste le da un lugar en la tabla periódica. Por ejemplo: el átomo de berilio: Be tiene cuatro protones y su número atómico es cuatro, el boro: B tiene cinco protones y su número atómico es cinco.
5.2.3 Masa atómica o número masa: A
Resulta de sumar la masa de todas las partículas, se simboliza con la letra A. Los elementos se representan en la tabla periódica indicando su número de masa y su número atómico.
5.2.4 Carga nuclear
Es la carga del núcleo. Siempre se positiva y se expresa en números enteros.
5.2.5 Masa nuclear
Es la masa del núcleo y corresponde a la suma de protones y neutrones. Ejemplos:
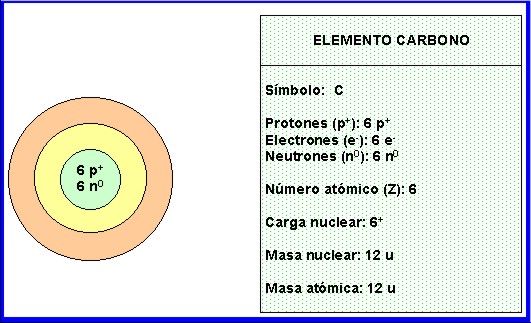
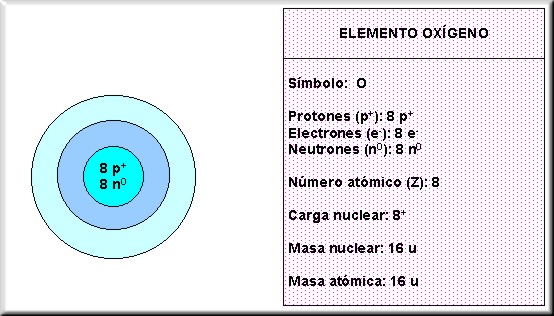
5.2.6 Isótopos
Son átomos de un mismo elemento que poseen el mismo número atómico o de protones, pero diferente masa molecular o número de neutrones.
5.2.7 Organización de la corteza atómica
Las ideas de varios científicos como el alemán Arnold Sommerfield (1916), del físico francés Louis De Broglie (1924), del físico Werner Heissemberg (1926) y del austríaco Erwin Schroedinger (1926) fueron fundamentales para sacar conclusiones sobre la corteza atómica: ¨ Cada electrón cuenta con cierta cantidad de energía que le permite alejarse en menor o mayor grado del núcleo. Esta energía, característica de cada electrón es la que determina los llamados niveles energéticos.
5.2.7.1 Niveles de energía

Niveles energéticos de un átomo.
Los niveles hacen relación a la cantidad de energía poseída por los electrones y al espacio donde existe la mayor posibilidad de encontrarlos. Cada electrón puede identificarse por la cantidad de energía que posee. Debido a esto, el nivel de energía constituye el llamado número cuántico principal (n).
· Si un electrón pasa de un nivel alejado del núcleo a uno más cercano, entonces emite energía. Por ejemplo: Cuando un electrón pasa del tercer nivel n = 3, al segundo nivel: n = 2, ocurre este fenómeno.
· Si el electrón pasa de un nivel inferior a uno superior, entonces, absorbe energía: · Por ejemplo, el paso de un tercer nivel: n = 3, a un cuarto nivel n = 4, entonces, sucede que el electrón que se encontraba en un estado fundamental o básico pasa a un estado excitado debido a que absorbe energía.
· Cuando el electrón se mueve en un mismo nivel, su energía es constante. Según un electrón, emita o absorba energía se forman una serie de espectros. En cada nivel de energía girarán o lo ocuparán un número determinado de electrones, el cual está limitado a un máximo (p) y se expresa mediante la fórmula:
Para obtener el número máximo de electrones que soporta un nivel de energía, reemplazamos n por los niveles de energía del 1 al 7. Así:
5.2.7.2 Subniveles de energía
Sommerfield planteó que los electrones de un mismo nivel energético tienen ligeras diferencias de energía, según si su trayectoria es circular o elíptica. Esto indica que cada nivel de energía se descompone en varios subniveles.
Los subniveles se representan con las letras minúsculas s, p, d, f. Su significación es la siguiente: · s, de sharp que en inglés significa "definido", p de la designación "principal", d de "difuso" y f de "fundamental".
Cada nivel cuenta con un número de subniveles igual a su valor. Así, por ejemplo:
-El nivel 1 tiene 1 subnivel.
-El nivel 2 tiene 2 subniveles.
- El nivel 3 tiene 3 subniveles.
- El nivel 4 tiene 4 subniveles.
- El nivel 5 tiene 4 subniveles.
- El nivel 6 tiene 4 subniveles.
- El nivel 7 tiene 4 subniveles.
Los electrones presentes en un subnivel poseen:
- Igual energía.
- Igual distancia con respecto al núcleo.
Representación gráfica de los subniveles de energía.
Los subniveles constituyen el segundo número cuántico, se representa por la letra "l" y sus valores numéricos son enteros. Identifica la región en la que se mueve el electrón o momento angular.
Aplicando la fórmula obtenemos los valores para cada nivel de energía.
5.2.7.3 Orbitales
El modelo de Bohr presentó deficiencias como el señalar que se podía encontrar con exactitud la posición y el impulso del electrón. Experimentalmente es imposible demostrarlo, puesto que al intentar localizar el electrón, inmediatamente él cambia su posición y su impulso.
Los orbitales representan el tercer número cuántico, ml, llamado número magnético, por que define la orientación del campo magnético originado por el movimiento del electrón en el orbital. Describen el espacio en donde existe mayor probabilidad de encontrarlo. El número de orbitales por subnivel cumple con la siguiente ecuación:
Representación grafica de los orbitales
5.2.7.4 Distribución electrónica
La forma como se distribuyen los electrones se representa de la siguiente forma:
En la distribución electrónica de cualquier elemento, se acostumbra escribir el número de electrones como exponente, estos al ser sumados originan el número atómico del elemento en. Para la realización de la distribución electrónica de un elemento, se ha elaborado una tabla que permite ver la variación de energía dentro de los niveles y subniveles de energía.
A continuación se detallan algunos elementos químicos y sus distribuciones electrónicas en los correspondientes niveles de energía.
5.2.7.5 Ejercicios resueltos
· Realizar la distribución electrónica del elemento Hierro (Fe), que tiene un número atómico de 26 ( Z = 26). Solución
1. El número para distribuir es 26, para realizar el ejercicio seguimos el sentido de las flechas, teniendo en cuenta que la suma de los exponentes nos dé exactamente 26 así,
· Realizar la distribución electrónica del Flúor ( F), el cual tiene un número atómico igual a 9 (Z = 9). Solución
1. El número para distribuir es 9, luego seguimos los pasos del ejercicio anterior así: seguimos el sentido de las flechas, hasta que la suma de los exponentes nos dé exactamente 9.
· Realizar la distribución electrónica del Flúor ( F), el cual tiene un número atómico igual a 9 (Z = 9). Solución
1. El número para distribuir es 9, luego seguimos los pasos del ejercicio anterior así: seguimos el sentido de las flechas, hasta que la suma de los exponentes nos dé exactamente 9.
3. Observe que a diferencia del caso anterior, acá no hay transposición de orbitales por que el número atómico es pequeño y sólo alcanza a llegar hasta el segundo nivel de energía y al subnivel p con 5 electrones.
La distribución electrónica nos permite conocer la ubicación exacta de un elemento en la tabla periódica, identificando grupo, periodo y región. En este caso se debe tener en cuenta:
1. La distribución electrónica está dada por tres características a saber:
· Número de nivel
· Número de electrones
· Tipo de subnivel
2. Cada una de éstas presentan otras informaciones a saber:
· Número de nivel. Número de periodo escrito en números arábigos.
· Número de electrones. Número de grupo se escribe en números romanos.
· Tipo de subnivel. Representa la región a la cual pertenece.
3. Cuando un elemento pertenece a la región p, para establecer el número de grupo, se deben sumar los electrones que se encuentran en "s" y "p". El número de grupo está determinado por los electrones de su último nivel de energía. Un ejemplo ilustrativo está dado por el elemento neón de número atómico (Z = 10).
· Distribución electrónica del neón:
Ejemplos:
· Realizar la distribución electrónica e identificar grupo y periodo para los siguientes elementos: berilio (Be), (Z = 4), boro (B), (Z = 5), carbono (C), (Z = 6), nitrógeno (N), (Z = 7) y oxígeno (O2), (Z = 8): Solución:
5.3 Molécula
Es la mínima unidad de sustancia pura o de un compuesto, que puede existir de manera estable e independiente. La molécula resulta de la unión de dos o más átomos de la misma o de diferente especie por medio de enlaces químicos.
Una gota de agua, se encuentra formada por millones de moléculas, o sea, la unión de millones de átomos de hidrógeno y oxígeno fuertemente unidos mediante enlaces covalentes. Existen varios tipos de moléculas de acuerdo con la cantidad de átomos que se encuentren unidos.
Ejemplo:
- Simples: cuando están formadas por átomos del mismo elemento. Pueden ser:
- Monoatómicas: si están formadas por un solo átomo. Como ejemplo, los gases nobles y los metales.
- Poliatómicas: si se encuentran formadas por varios átomos. Según el número de átomos unidos pueden ser:
- Diatómicas: dos átomos.
- Triatómicas: tres átomos.
- Tetratómicas: cuatro átomos.
- Hexatómoicas: seis átomos.
- Octatómicas: ocho átomos. Al número de átomos del mismo elemento que unidos forman una molécula simple, se conoce como atomicidad.
- Compuestas: cuando están formadas por dos o más átomos de diferentes elementos.
5.4 Recordemos el átomo